Clorosilano
In questo articolo esploreremo l'impatto di Clorosilano sulla società moderna. Dalla sua nascita alla sua evoluzione negli ultimi anni, Clorosilano ha svolto un ruolo fondamentale in diversi aspetti della vita quotidiana. Attraverso un'analisi dettagliata, esamineremo come Clorosilano ha influenzato il modo in cui le persone si relazionano, lavorano e giocano. Inoltre, esamineremo le possibili implicazioni future di Clorosilano e come questo potrebbe plasmare ulteriormente la nostra società negli anni a venire.
| Clorosilano | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| monoclorosilano | |
| Nomi alternativi | |
| cloruro di silile, sililcloruro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | SiH3Cl |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 236-705-7 |
| PubChem | 61622 |
| SMILES | Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,145 |
| Solubilità in acqua | si decompone |
| Temperatura di fusione | -118 °C (155 K) |
| Temperatura di ebollizione | -30,4 °C (242,75 K) |
| Indicazioni di sicurezza | |
| Punto di fiamma | -90 °C (183 K) |
| Simboli di rischio chimico | |
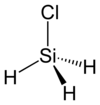
Il clorosilano o cloruro di silile è un alosilano avente formula H3Si-Cl, molecola analoga a quella del cloruro di metile H3C-Cl ed ad essa isoelettronica di valenza. A temperatura ambiente questo composto si presenta come un gas incolore, più denso dell'aria e molto reattivo.
Struttura molecolare e proprietà
La molecola, derivante formalmente da quella tetraedrica del silano (SiH4) per sostituzione di un H con un atomo di cloro, è ancora di tipo tetraedrico, ma non regolare, la cui simmetria è più bassa (C3v invece di Td);[1] questo accade poiché l'atomo di silicio centrale ibridato sp3[2] non è legato a quattro atomi uguali. Come atteso per la presenza del Cl che è più elettronegativo di Si e H, la molecola è polare (μ = 1,31 D),[3] ma parecchio meno di CH3Cl (1,8974 D[4]); la sua minore polarità si riflette anche in una maggiore volatilità rispetto ad esso, testimoniata dal punto di ebollizione più basso (-30,4 °C contro -24 °C.), come pure si verifica per i punti di fusione (-118 °C contro -97 °C).[5]
Da indagini spettroscopiche roto-vibrazionali (microonde e infrarosso) è stato possibile ricavare, tra l'altro, distanze ed angoli di legame:[6]
r(Si–H)) = 147,5 pm; r(Si–Cl) = 205,1 pm;
∠(HSiH) = 110,62°; ∠(HSiCl) = 108,295°.
I legami Si–H sono impercettibilmente più corti di quelli in SiH4 (148,0 pm[7]), mentre il legame Si–Cl è lievemente più lungo del normale (202 pm).[8]
Gli angoli HSiH sono un po' più ampi del valore tetraedrico di109,5°, mentre quelli HSiCl ne sono un po' minori: questo è in accordo con la ripartizione del carattere s e p nell'ibrido, che è in favore del primo per atomi meno elettronegativi, e viceversa, in accordo con la regola di Bent.[9][10]
Pur essendo termodinamicamente stabile (ΔHƒ° = -141,84 kJ/mol),[11] il clorosilano è estremamente reattivo nei confronti dell'ossigeno, pericolosamente infiammabile all'aria (può essere piroforico)[2] e estremamente reattivo nei confronti dell'umidità,[5] con la quale si idrolizza rapidamente, e ancor più velocemente con l'acqua, formando acido cloridrico e, inizialmente, il silanolo (H3Si-OH).[12]
Sintesi e reattività
Il clorosilano si forma, in miscela con altri clorosilani SiH4-nCln, trattando il silano SiH4 con HCl in presenza di AlCl3 come catalizzatore; dato che i punti di ebollizione di questi clorosilani sono sufficientemente distanziati, è possibile recuperare ciascun componente per distillazione.[13] In laboratorio si ottiene più convenientemente, e più puro, facendo reagire il silano con cloruro di argento a 260 °C:[14]
SiH4 (g) + 2 AgCl (s) → SiH3Cl (g) + HCl (g) + 2 Ag (s)
Reagisce con l'ammoniaca per dare la trisililammina:[15]
3 SiH3Cl + 4 NH3 → (SiH3)3N + 3 NH4Cl
Reagisce con reattivi alchillitio per dare monoalchilsilani; ad esempio, con il butillitio fornisce il butilsilano:
SiH3Cl + n-BuLi → n-Bu-SiH3 + LiCl
Un'analisi della decomposizione termica (533 °C) mostra che SiH3Cl genera durante il processo il sililene SiHCl, che risulta dall'iniziale rapida eliminazione di una molecola di idrogeno, come accade comunemente anche per altri clorosilani e silani in genere.[16]
Note
- ^ CCCBDB listing of experimental data page 2, su cccbdb.nist.gov. URL consultato il 12 febbraio 2023.
- ^ a b (EN) Silanes (PDF), su gelest.com, p. 39.
- ^ chlorosilane, su www.stenutz.eu. URL consultato l'11 febbraio 2023.
- ^ (EN) G. Wlodarczak, F. Herlemont e J. Demaison, Combined subdoppler laser-Stark and millimeter-wave spectroscopies: Analysis of the ν6 band of CH335Cl, in Journal of Molecular Spectroscopy, vol. 112, n. 2, 1º agosto 1985, pp. 401-412, DOI:10.1016/0022-2852(85)90171-7. URL consultato il 2 agosto 2022.
- ^ a b CHLOROSILANE---Chemical Information Search, su www.chemicalbook.com. URL consultato il 10 febbraio 2023.
- ^ (EN) Structure of Free Polyatomic Molecules, DOI:10.1007/978-3-642-45748-7. URL consultato il 12 febbraio 2023.
- ^ D. R. J. Boyd, Infrared Spectrum of Trideuterosilane and the Structure of the Silane Molecule, in The Journal of Chemical Physics, vol. 23, n. 5, 1º maggio 1955, pp. 922-926, DOI:10.1063/1.1742148. URL consultato il 12 febbraio 2023.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, pp. 231-236, ISBN 88-299-1470-3.
- ^ A. F. Holleman, E. Wiberg e N. Wiberg, Anorganische Chemie, 103ª ed., De Gruyter, 2016, pp. 398-399, ISBN 978-3-11-026932-1.
- ^ M. W. Chase, NIST-JANAF Themochemical Tables, Fourth Edition, 1998, pp. 1-1951. URL consultato il 10 febbraio 2023.
- ^ (EN) Silicon-Chlorine Bonded Molecules, su Engineering LibreTexts, 9 agosto 2016. URL consultato l'11 febbraio 2023.
- ^ (EN) César Ramírez-Márquez e Mariano Martín, Chapter 10 - Photovoltaic solar energy, Elsevier, 1º gennaio 2022, pp. 397-439, DOI:10.1016/b978-0-12-824324-4.00029-9, ISBN 978-0-12-824324-4. URL consultato l'11 febbraio 2023.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 339, ISBN 0-7506-3365-4.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 360, ISBN 0-7506-3365-4.
- ^ Thermal decomposition of chlorosilanes
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su clorosilano
Wikimedia Commons contiene immagini o altri file su clorosilano