Adalimumab
Nel mondo di oggi, Adalimumab ha acquisito una rilevanza senza precedenti. Sia nel campo della scienza, della cultura, dell'intrattenimento o della politica, Adalimumab è diventato un argomento fondamentale di discussione e analisi. Il suo impatto ha trasceso i confini e ha generato un grande dibattito nella società contemporanea. Per comprenderne l’importanza e le implicazioni è necessario effettuare uno studio approfondito e dettagliato che permetta di approfondire tutte le sue dimensioni. In questo articolo esploreremo diversi aspetti legati a Adalimumab, dalla sua origine alla sua influenza nel mondo di oggi, con l'obiettivo di far luce su questo argomento così attuale oggi.
| Adalimumab | |
|---|---|
 | |
| Caratteristiche generali | |
| Massa molecolare (u) | 144190,3 g/mol |
| Numero CAS | |
| Numero EINECS | 695-701-7 |
| Codice ATC | L04 |
| DrugBank | DBDB00051 |
| Dati farmacocinetici | |
| Emivita | 10 -20 giorni |
| Indicazioni di sicurezza | |
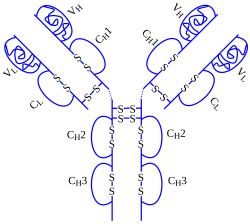
L'adalimumab (nome commerciale Humira) è l'anticorpo monoclonale umano che riconosce come antigene il TNF-alfa; è un farmaco biologico e viene utilizzato in medicina per ridurre il dolore e la flogosi in alcune malattie artritiche.
Indicazioni
Viene utilizzato come terapia contro l'artrite psoriasica e l'artrite reumatoide nelle forme più gravi.
Avvertenze
Tossicità centrale: gli inibitori del TNF-alfa sono stati associati, raramente, a patologie demielinizzanti come la sclerosi multipla e la sindrome di Guillan-Barré[1][2]. Somministrare adalimumab con estrema cautela in caso di pazienti con patologie demielinizzanti preesistenti o di recente manifestazione.
Neoplasie maligne e malattie linfoproliferative: nei trial clinici in pazienti trattati con inibitori del TNF-alfa, l'incidenza di neoplasie maligne, soprattutto linfoma, è risultata maggiore rispetto ai gruppi di controllo. Durante la sorveglianza postmarketing è stata osservata una tendenza all'aumento di leucemie nei pazienti trattati con farmaci anti-TNF. Nei pazienti con artrite reumatoide attiva di lunga durata è stato osservato un aumento dell'incidenza di linfomi e leucemie: questo fatto complica la valutazione del rischio per gli anti-TNF.
Tumori anche fatali sono stati riportati nei bambini e nei giovani adulti (età < 23 anni) trattati con farmaci anti-TNF (sorveglianza postmarketing). Circa la metà di questi tumori era rappresentato da linfomi. Sulla base dei dati di letteratura e delle segnalazioni postmarketing raccolte, nell'aprile 2011 la FDA ha incominciato un'analisi del profilo di sicurezza, relativamente al rischio di tumore, dei farmaci anti-TNF nei pazienti con età uguale o inferiore a 30 anni[3].
Come con infliximab, anche con adalimumab sono stati riportati casi di linfoma epatosplenico a cellule T (sorveglianza postmarketing). Questo linfoma, raro, con decorso rapido e aggressivo è stato segnalato in pazienti in terapia con adalimumab e azatioprina o 6- mercaptopurina. Poiché non è stato stabilito il ruolo dell'associazione farmacologica nello sviluppo del linfoma epatosplanico a cellule T, il rischio di questo tipo di tumore non può essere escluso per la monoterapia con adalimumab.
Durante la terapia con adalimumab devono essere monitorati con attenzione segni o sintomi riconducibili a tumori della pelle diversi dal melanoma, soprattutto in pazienti che sono già stati sottoposti a terapia immunosoppressiva intensa o che, a causa della psoriasi, hanno ricevuto trattamenti PUVA (psoralene più raggi UVA). Poiché inoltre è stato osservato un aumento del rischio di tumori, soprattutto al polmone e alla testa e collo, in pazienti fumatori con malattia polmonare cronica ostruttiva (COPD) trattati con infliximab, altro inibitore del TNF-alfa, anche per adalimumab è raccomandata cautela in caso di somministrazione a pazienti con COPD e/o fumatori (fattore di rischio tumorale). Sebbene il TNF alfa intervenga nella sorveglianza immunologica contro i tumori, non è noto il rischio in caso di somministrazione di adalimumab in pazienti con forme maligne recenti.
Anticorpi anti-adalimumab: la terapia con adalimumab può portare a formazione di anticorpi anti-adalimumab che risultano associati a un aumento della clearance del farmaco e a una sua minor efficacia terapeutica. Non è stata individuata correlazione fra la formazione di questo tipo di anticorpi e l'incidenza di reazioni collaterali del farmaco. Nei pazienti affetti da artrite reumatoide, l'analisi dei dati degli studi clinici (tempo di osservazione: 6-12 mesi) ha evidenziato un'incidenza di anticorpi anti-adalimumab del 5,5% nei pazienti trattati con l'anticorpo monoclonale rispetto allo 0,5% dei pazienti nel gruppo placebo. L'uso di metotrexato ha ridotto l'immunogenicità di adalimumab (incidenza di anticorpi anti-adalimumab: 0,6% vs 12,4% rispettivamente con o senza metotrexato).
Analoga tendenza è stata osservata anche nei pazienti pediatrici trattati con adalimumab per artrite idiopatica poliarticolare, con percentuali però maggiori (incidenza anticorpi anti-adalimumab: 15,8% dei pazienti; 5,9% vs 25,6% dei pazienti rispettivamente trattati con o senza metotrexato); nei pazienti con artrite psoriasica (incidenza anticorpi anti-adalimumab: 10% dei pazienti; 7% vs 13,5% dei pazienti rispettivamente trattati con o senza metotrexato); nei pazienti con spondilite anchilosante (incidenza anticorpi anti-adalimumab: 8,3% dei pazienti; 5,3% vs 8,6% dei pazienti rispettivamente trattati con o senza metotrexato); nei pazienti con malattia di Crohn (incidenza anticorpi anti-adalimumab: 2,6%); nei pazienti con psoriasi (incidenza anticorpi anti-adalimumab: 8,4%).
In pazienti con artrite reumatoide seguiti per 3 anni e trattati con adalimumab, anticorpi anti-adalimumab sono stati osservati nel 28% dei pazienti e nel 67% di questi pazienti gli anticorpi erano già presenti entro le prime 28 settimane di trattamento. L'assenza di anticorpi è risultata associata a concentrazioni di adalimumab maggiori rispetto a quelle osservate nei pazienti con anticorpi anti-farmaco e a tassi di interruzione del trattamento per mancanza di efficacia, minori (14% vs 38%, HR 3,0). Inoltre, nei pazienti che non hanno sviluppato gli anticorpi anti-adalimumab, la percentuale di pazienti con attività di malattia minima (48% vs 13%) e in remissione (34% vs 4%) è risultata maggiore rispetto ai pazienti che avevano sviluppato gli anticorpi verso l'adalimumab[4]. Nei pazienti con malattia infiammatoria cronica intestinale, gli anticorpi anti-adalimumab tendono a persistere per lungo tempo (probabilmente oltre l'anno) dopo la fine della terapia farmacologica (nei pazienti trattati con infliximab, gli anticorpi anti-farmaco tendono a scomparire entro l'anno seguente la fine del trattamento)[5].
Gravidanza: l'esperienza dell'uso di adalimumab in gravidanza è limitata. La somministrazione del farmaco in gravidanza richiede un'attenta valutazione del rapporto rischio/beneficio[6]. La FDA ha inserito adalimumab (specialità medicinale Humira) in classe B per l'uso in gravidanza. In questa classe sono inseriti i farmaci per i quali gli studi riproduttivi sugli animali non hanno evidenziato un rischio per il feto e non sono disponibili studi analoghi nell'uomo e i farmaci per i quali gli studi preclinici in vivo hanno mostrato tossicità (oltre a decremento della fertilità), ma tali effetti tossici non sono stati confermati in studi controllati in donne nel primo trimestre di gravidanza e non c'è evidenza di danno nelle fasi avanzate della gravidanza.
Meccanismo di azione
L'adalimumab ha diversi effetti sul TNF, modificando la sua risposta biologica
Controindicazioni
Controindicata in persone con formazioni tumorali e in genere malattia demielinizzanti serie.
Effetti indesiderati
Infezioni respiratorie, anemia, vertigini, linfopenia, cefalea, nausea, tosse, ipertensione.
Rari
Insonnia, disgeusia, glaucoma, blefarite, disfagia, mialgia.
Note
- ^ Cesarini M. et al., J. Crohns Colitis., 2011, 5 (6), 619
- ^ Lopez Mendez P. et al., Reumatol., Clin., 2011, 7 (6), 401.
- ^ FDA Drug Safety Communication, su fda.gov, 2011.
- ^ Bartelds G.M. et al., JAMA, 2011, 305 (14), 1460.
- ^ Ben-Horin S. et al., Aliment Pharmacol Ther., 2012, 35 (6), 714.
- ^ Gisbert J.P. et al., Inflamm. Bowel Dis., 2010, 16 (5), 881.
Bibliografia
- Frank Ashall, Le grandi scoperte scientifiche, Armando Editore, 1999, pp. 245–, ISBN 978-88-7144-949-4.
- Abul K. Abbas, Andrew H. Lichtman e Shiv Pillai, Immunologia cellulare e molecolare, Elsevier srl, 2010, pp. 79–, ISBN 978-88-214-3176-0.
- Abul K. Abbas e Andrew H. Lichtman, Le basi dell'immunologia, Elsevier srl, 2006, pp. 70–, ISBN 978-88-85675-85-8.
- Humphrey P. Rang, M. Maureen Dale e James M. Ritter, Farmacologia, Elsevier srl, 2008, pp. 778–, ISBN 978-88-214-3023-7.
- Enzo Fagiolo, Immunoematologia, Mediserve s.r.l., 2007, pp. 16–, ISBN 978-88-8204-135-9.
- Paolo Larizza, Trattato di medicina interna, Piccin, 2005, pp. 909–, ISBN 978-88-299-1721-1.
- Angelo Sghirlanzoni, Terapia Delle Malattie Neurologiche, Springer, 3 aprile 2010, pp. 113–, ISBN 978-88-470-1119-9.
- Thomas C. King, Patologia, Elsevier srl, 2008, pp. 156–, ISBN 978-88-214-3019-0.
- WHO-Lista INN degli Anticorpi monoclonali (PDF), su whqlibdoc.who.int.
- (EN) Marie A. Simmons, Monoclonal antibodies: new research, Nova Publishers, 2005, ISBN 978-1-59454-247-3.
- (EN) Zhiqiang An, Therapeutic Monoclonal Antibodies: From Bench to Clinic, John Wiley and Sons, 8 settembre 2009, ISBN 978-0-470-11791-0.
- (EN) James W. Goding, Monoclonal antibodies: principles and practice : production and application of monoclonal antibodies in cell biology, biochemistry and immunology, Academic Press, 1996, ISBN 978-0-12-287023-1.
- (EN) Steve Shire, Current Trends in Monoclonal Antibody Development and Manufacturing, Springer, aprile 2009, ISBN 978-0-387-76642-3.
Adalimumab
- (EN) John M. Walker e Ralph Rapley, Molecular biomethods handbook, Springer, 2008, pp. 557–, ISBN 978-1-60327-370-1.
- (EN) E. William St. Clair, David S. Pisetsky e Barton F. Haynes, Rheumatoid arthritis, Lippincott Williams & Wilkins, 2004, pp. 380–, ISBN 978-0-7817-4149-1.
- (EN) Peter Tugwell, Evidence-based rheumatology, John Wiley and Sons, 2004, pp. 268–, ISBN 978-0-7279-1446-0.
- (EN) John M. Walker e Ralph Rapley, Molecular biomethods handbook, Springer, 2008, pp. 557–, ISBN 978-1-60327-370-1.
- (EN) Anthony A. Gaspari e Stephen K. Tyring, Clinical and Basic Immunodermatology, Springer, 25 novembre 2008, pp. 514–, ISBN 978-1-84800-164-0.
- (EN) Manzoor M. Khan, Immunopharmacology, Springer, 24 ottobre 2008, pp. 115–, ISBN 978-0-387-77975-1.
- (EN) accessdate John H. Klippel, Primer on the rheumatic diseases, Springer, 29 luglio 2008, pp. 213–, ISBN 978-0-387-35664-8.
Altri progetti
 Wikimedia Commons contiene immagini o altri file su Adalimumab
Wikimedia Commons contiene immagini o altri file su Adalimumab