Forza di Debye
In questo articolo esploreremo l'affascinante mondo di Forza di Debye e tutte le implicazioni che ha sulla nostra società attuale. Dal suo impatto sulla vita quotidiana alla sua rilevanza nel campo professionale, Forza di Debye ha dimostrato di essere un argomento di crescente interesse per persone di tutte le età e professioni. In queste pagine approfondiremo le origini, l'evoluzione e le prospettive future di Forza di Debye, per comprenderne meglio l'importanza nel contesto attuale. Inoltre, analizzeremo i vari approcci e opinioni che esistono attorno a Forza di Debye, con l’obiettivo di fornire una visione completa e arricchente di questo argomento così attuale oggi. Unisciti a noi in questo viaggio di scoperta e riflessione su Forza di Debye!
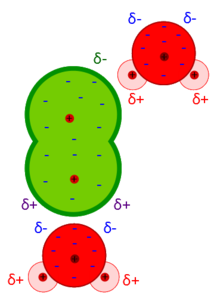
Le Forze di Debye sono forze intermolecolari risultanti dall'interazione di un dipolo permanente ed un dipolo indotto. Le forze di Debye fanno parte delle forze di van der Waals ed esprimono l'effetto d'induzione.
Dipolo indotto
Tutti gli atomi e molecole sono polarizzabili. Certi tipi di polarizzabilità risultano dalla deformazione della nuvola elettronica in presenza di un campo elettrico, che può essere esterno o generato da una molecola polare; il dipolo indotto viene definito come:
dove è la polarizzabilità della molecola ed è l'intensità del campo elettrico.
Interazione dipolo permanente-dipolo indotto
Molecola polare vs molecola apolare
Il potenziale d'interazione dipende dal momento dipolare della molecola polare (1).
Molecola polare vs molecola polare
In questo caso una molecola determina un dipolo indotto sull'altra molecola e viceversa. Il potenziale è definito come:




